Tabla periódica
domingo, 24 de diciembre de 2017
miércoles, 29 de noviembre de 2017
Tabla Periódica
La tabla periódica es un documento que abarca elementos químicos. En los cuales están clasificados en sólidos, líquidos, y gaseoso (algunos pueden ser radioactivos y hechos artificialmente). Tiene 118 elementos, cada uno tiene su peso atómico, valencias, estructura atómica, símbolo, número atómico, densidad, punto de fusión y punto de ebullición.
Las filas de la tablas se denominan periodos y las columnas grupos. Algunos grupos tienen nombres. Así por ejemplo el grupo 17 es el de los halógenos y el grupo 18 el de los gases nobles. La tabla también se divide en cuatro bloques con algunas propiedades químicas similares. Aunque algunos elementos como el oro (Au), plata (Ag), cobre (Cu), plomo (Pb) y mercurio(Hg) ya eran conocidos desde la antigüedad, el primer descubrimiento científico de un elemento ocurrió en el siglo XVII, cuando el alquimista Henning Brand descubrió el fósforo (P). En el siglo xviii se conocieron numerosos nuevos elementos, los más importantes de los cuales fueron los gases, con el desarrollo de la química neumática: oxígeno (O), hidrógeno (H) y nitrógeno (N). También se consolidó en esos años la nueva concepción de elemento, que condujo a Antoine Lavoisier a escribir su famosa lista de sustancias simples, donde aparecían 33 elementos.
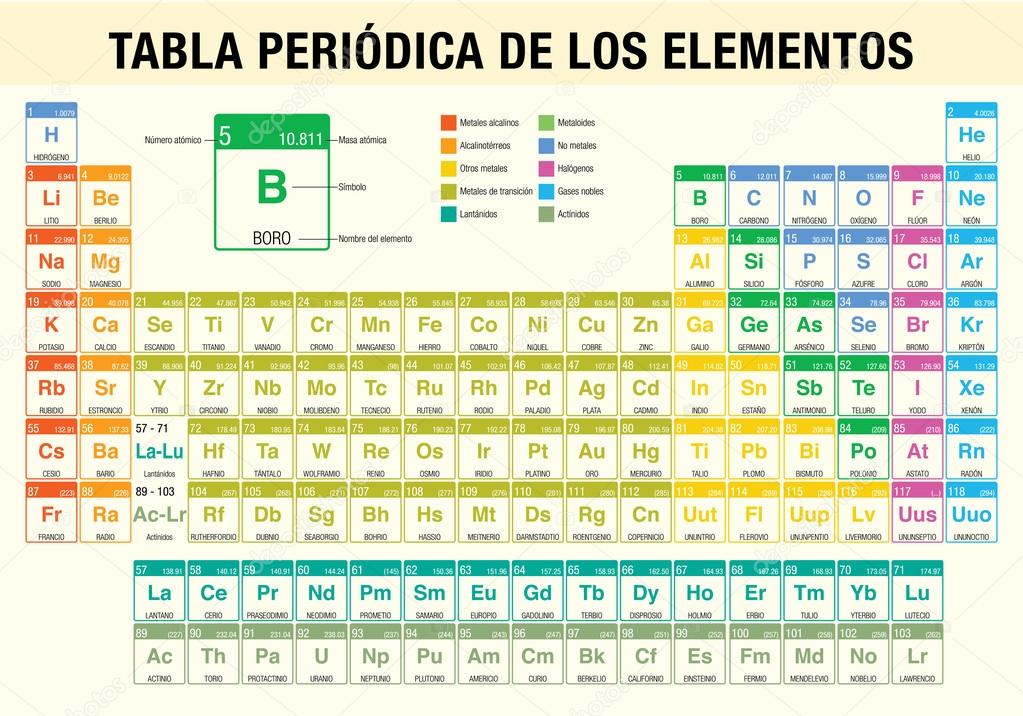
Las filas de la tablas se denominan periodos y las columnas grupos. Algunos grupos tienen nombres. Así por ejemplo el grupo 17 es el de los halógenos y el grupo 18 el de los gases nobles. La tabla también se divide en cuatro bloques con algunas propiedades químicas similares. Aunque algunos elementos como el oro (Au), plata (Ag), cobre (Cu), plomo (Pb) y mercurio(Hg) ya eran conocidos desde la antigüedad, el primer descubrimiento científico de un elemento ocurrió en el siglo XVII, cuando el alquimista Henning Brand descubrió el fósforo (P). En el siglo xviii se conocieron numerosos nuevos elementos, los más importantes de los cuales fueron los gases, con el desarrollo de la química neumática: oxígeno (O), hidrógeno (H) y nitrógeno (N). También se consolidó en esos años la nueva concepción de elemento, que condujo a Antoine Lavoisier a escribir su famosa lista de sustancias simples, donde aparecían 33 elementos.

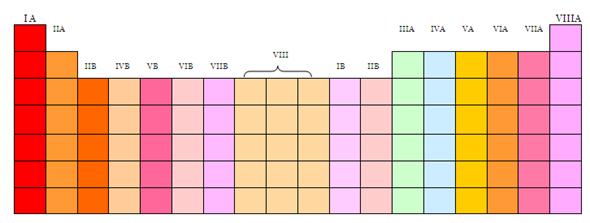
Características de la tabla periodica
Grupos:
Estos grupos se encuentran formados mediante los elementos que cuentan con similitud entre ellos.
El número o número atómico:
Es el número añadido a cada elemento y van ordenados según el número de protones contenidos por elemento.
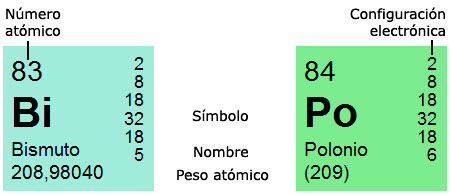 Masa de los elementos:
Masa de los elementos:
Esta es la denominación establecida en base a los protones y neutrones del núcleo de cada elemento.

Color:
Electrones:Estos son el número o cantidad de electrones que contiene a nivel energético un átomo.


Esta es la denominación establecida en base a los protones y neutrones del núcleo de cada elemento.
Color:
Los colores son utilizados para separar los tipos de elementos que existen y son el amarillo, naranja, verde, azul, rojo, morado y lila.
Electrones:Estos son el número o cantidad de electrones que contiene a nivel energético un átomo.

martes, 28 de noviembre de 2017
Estados de los elementos.
Estado gaseoso: se denomina gas al estado de agregación de la materia compuesto principalmente por moléculas no unidas, expandidas y con poca fuerza de atracción, lo que hace que los gases no tengan volumen y forma definida, y se expandan libremente hasta llenar el recipiente que los contiene. Su densidad es mucho menor que la de los líquidos y sólidos, y las fuerzas gravitatorias y de atracción entre sus moléculas resultan insignificantes. En algunos diccionarios el término gas es considerado como sinónimo de vapor, aunque no hay que confundir sus conceptos: vapor se refiere estrictamente a aquel gas que se puede condensar por presurización a temperatura constante. Como ejemplo: Nitrogeno.
Estado líquido: es un estado de agregación de la materia en forma de fluido altamente incomprensible, lo que significa que su volumen es, bastante aproximado, en un rango grande de presion. Es el único estado con un volumen definido, pero no con forma fija. Como ejemplo: Bromo
Estado Plasma: al cuarto estado de agregación de la materia, un estado fluido similar al estado gaseoso pero en el que determinada proporción de sus partículas están cargadas eléctricamente y no poseen equilibrio electromagnético, por eso son buenos conductores eléctricos y sus partículas responden fuertemente a las interacciones electromagnéticas de largo alcance. Como ejemplo: las luces de neon.
lunes, 27 de noviembre de 2017
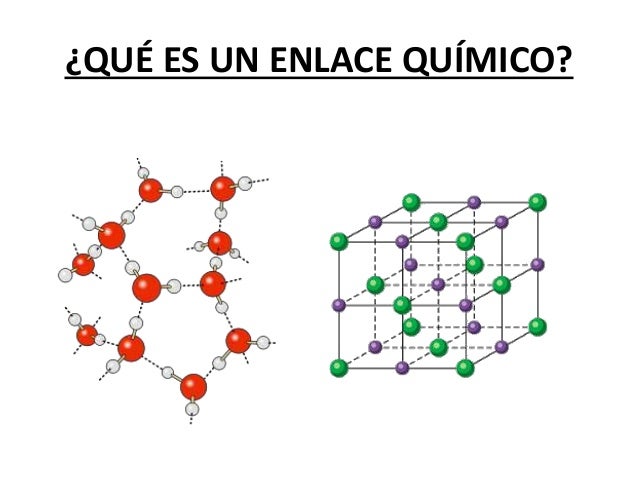
Enlaces químicos.
Un enlace químico es la interacción física responsable de las fusiones entre átomos, moléculas e iones, que tiene una estabilidad en los compuestos diatómicos y poliatómicos, que conectan entre sí para dar más electrones.
Los enlaces mas comunes son: enlace ionico y enlace covalente
Enlace ionico: se basa en la transferencia de electrones. (solo para la relacion entre Metales y NO Metales). Ejemplo: Na (sodio) + Cl (cloro) -> Na º + ºººClºººº = ººººNaClººº. Los "º" representa las cantidades de electrones que poseen los elementos, el Sodio (Na) es un Metal y el Cloro (Cl) es un NO Metal, significa que se puede lograr hacer el enlace ionico. El metal (Sodio-Na) pierde su electron para transferirlo a el NO metal (Cloro-Cl) y el NO metal queda con 8 electrones.
Enlace covalente: es la union de los electrones de dos elementos NO metales. Ejemplo:
OH3 -> Hº + Hº + ºººO ººº+ Hº. Los electrones se unen y forman un oxigeno equilibrado.
Los enlaces mas comunes son: enlace ionico y enlace covalente

Enlace ionico: se basa en la transferencia de electrones. (solo para la relacion entre Metales y NO Metales). Ejemplo: Na (sodio) + Cl (cloro) -> Na º + ºººClºººº = ººººNaClººº. Los "º" representa las cantidades de electrones que poseen los elementos, el Sodio (Na) es un Metal y el Cloro (Cl) es un NO Metal, significa que se puede lograr hacer el enlace ionico. El metal (Sodio-Na) pierde su electron para transferirlo a el NO metal (Cloro-Cl) y el NO metal queda con 8 electrones.
Enlace covalente: es la union de los electrones de dos elementos NO metales. Ejemplo:
OH3 -> Hº + Hº + ºººO ººº+ Hº. Los electrones se unen y forman un oxigeno equilibrado.
domingo, 26 de noviembre de 2017
Ventajas de la tabla periodica de Mendeleuv
1. Mendeleiev ordenó a los elementos químicos en orden creciente a su peso atómico. Actualmente se ordena a los elementos en orden creciente a su número atómico.


2. Mendeleiev solo consideró 8 grupos o familias de elementos. Actualmente se conocen 18 grupos
3. Una ventaja de la tabla de Mendeleiev fue que todos los elementos químicos pertenecientes a un mismo grupo o familia tenían las mismas propiedades químicas y el mismo número de valencia.
4. Mendeleiev solo consideró que un elemento químico solo tenia 1 valencia. Actualmente se conocen que los elementos químicos tienen mas de 1 valencia
5. Una ventaja de la tabla de Mendeleiev fue que dejo casilleros en blanco, prediciendo la existencia de nuevos elementos químicos.
5. Una ventaja de la tabla de Mendeleiev fue que dejo casilleros en blanco, prediciendo la existencia de nuevos elementos químicos.
sábado, 25 de noviembre de 2017
Desventajas de la tabla periodica de Mendeleuv
1. Una desventaja o incompatibilidad en la tabla periódica de Mendeleiev fue que hubieron algunos elementos que no cumplieron el orden creciente de sus pesos atómicos.

2. Una desventaja de la tabla de Mendeleiev fue que no consideró a los gases nobles (en ese momento aún no se habian descubierto)
3. Los elementos metálicos y no metálicos no estaban bien diferenciados dentro de la organización de la tabla periódica.

2. Una desventaja de la tabla de Mendeleiev fue que no consideró a los gases nobles (en ese momento aún no se habian descubierto)
3. Los elementos metálicos y no metálicos no estaban bien diferenciados dentro de la organización de la tabla periódica.
Suscribirse a:
Entradas (Atom)
-
1. Una desventaja o incompatibilidad en la tabla periódica de Mendeleiev fue que hubieron algunos elementos que no cumplieron el orden crec...
-
1. Mendeleiev ordenó a los elementos químicos en orden creciente a su peso atómico. Actualmente se ordena a los elementos en orden crecient...
-
Un enlace químico es la interacción física responsable de las fusiones entre átomos , moléculas e iones , que tiene una estabilidad ...

